
Сайт дистанционных консультаций для студентов заочной формы обучения товароведческого факультета ФГОУ ВПО ИВМ ОмГАУ специальностей "Товароведение и экспертиза товаров" и "Стандартизация и сертификация".
Биохимия продуктов питания
Лекция 1. Основные питательные вещества организма и продуктов питания. Белки. Состав и структура
План
1. Понятие об основных веществах организма и продуктов питания. Роль белковых веществ в явлениях жизни.
2. Аминокислотный состав белков
3. Принципы структурной организации белков
4. Незаменимые аминокислоты. Роль аминокислот в обмене веществ и пищевой технологии.
5. Углеводы. Липиды.Пептиды.
1. Понятие об основных веществах организма и продуктов питания. Роль белковых веществ в явлениях жизни
Живая природа характеризуется рядом свойств, отличающих ее от неживой природы, и почти все эти свойства связаны с белками. Белки составляют основу как структуры, так и функций живых организмов. По образному выражению одного из основоположников молекулярной биологии Ф. Крика, белки важны прежде всего потому, что они могут выполнять самые разнообразные функции, причем с необыкновенной легкостью и изяществом.
С чем связана необходимость поступления белков в организм с пищей? Ежесуточно 400 г белка из 6 кг, составляющих белковый "фонд" организма, подвергается распаду и должно быть возмещено эквивалентным количеством вновь образованных белков за счет биосинтеза из аминокислот. Так как резерва аминокислот в организме нет, то они должны поступать в составе белков пищи.
Белки или протеины (от лат. protos-первый) высокомолекулярные соединения, образованные из остатков α-аминокислот, связанных между собой пептидными связями.
Каждый организм характеризуется уникальным набором белков. В организме человека имеется около 50000 разнообразных белков. В природе встречается примерно 10 10 10 12 различных белков, обеспечивающих существование миллионов видов живых организмов.
Массовая доля белков, рассчитанная на сухое вещество в вегетативных органах растений: от 30 до 40% (семена злаков 8-12%; семена бобовых 25 46 %; клубни картофеля 0,5 2%).
Массовая доля белков животных тканей в среднем 50% (80% легкие, мышцы; 45% головной мозг). Из расчета на сухую массу в белках содержится 15-17% %
Функции белков в организме чрезвычайно важны и многообразны:
1. Структурная и опорная. Эту функцию выполняют белки соединительной ткани, костной ткани коллагены, эластин, кератины. По количеству эти белки занимают первное место среди других белков тела животного. В комплексе с фосфолипидами белки участвуют в образовании мембран клеток.
2. Каталитическая. Все ферменты являются белками. Выделено из биологических объектов и изучено более 2000 различных ферментов. Эта функция является уникальной, определяющей скорость химических реакций в биологических системах.
3. Двигательная (сократительная). Выполняется белками мышц миозином, актином.
4. Транспортная. Характерна для белков крови трансферрина транспор железа), церулоплазмина (транспорт меди), кальций-связывающего белка, альбуминов (транспорт липидов).
5.Дыхательная. Эта функция переноса кислорода и углекислого газа присуща белку крови гемоглобину и белку мышц миоглобину.
6.Защитную функцию выполняют белки иммуноглобулины важнейшие факторы иммунитета. Защитная функция белков проявляется и с способности ряда белков крови (протромбина, фибриногена) к свертыванию коагуляции). Свертывание белка плазмы крови фибриногена приводит к образованию тромба, что предотвращает кровопотери организма.
7.Регуляторная (гормональная). Функция белков гормонов инсулина, соматотропного гормона (СТГ), а также пептидов адренокортикотропного гормона (АКТГ), вазопрессина и др.
8.Рецепторную функцию выполняют белки гликопротеины и лектины. Они осуществляют избирательное узнавание и присоединение веществ к мембранам клеток.
9.Питательная (резервная) функция осуществляются белками, являющиеся источниками питания для развития плода, например, белки яиц, белок молока казеин.
2. Аминокислотный состав белков
Мономерами белков являются ά-аминокислоты L-ряда. Молекулы природных белков построены из 20 основных аминокислот: глицин, аланин, пролин, цистеин, серин, глутаминовая кислота, аспарагиновая кислота, глутамин, аспарагин, тирозин, гистидин, аргинин, лейцин изолейцин, фенилаланин, метионин, валин, триптофан, треонин, лизин. Редко встречаются аминокислоты (АК) оксипролин, оксилизин. В клетках растений синтезируются все аминокислоты, у человека и животных в организме не могут синтезироваться радикалы 8 аминокислот. А так как для синтеза белков в организме животных и человека необходимы все 20 аминокислот, то несинтезирующиеся в животном организме аминокислоты назвали незаменимыми (лейцин изолейцин, фенилаланин, метионин, валин, триптофан, треонин, лизин), гистидин и аргинин условно незаменимые так как в небольшом количес тве синтезируются в животном организме.
Классификация аминокислот:
по составу углеводородного радикала:
1. алифатические аминокислоты: гли, ала, вал, лей, иле, радикал гидрофобный
а) гидроксиаминокислоты: сер, тре,тир. Радикалы этих аминокислот имеют полярный незаряженный радикал.
б) моноаминодикарбоновые аминокислоты глу и асп, они имеют полярный заряженный отрицательно радикал.
в) диаминомонокарбоновые кислоты арг и лиз имеют полярный заряженный положительно радикал.
2. ароматические аминокислоты фен, тир, тир.
3. иминоаминокислоты про, гис.
4. серусодержащие цис, цистеин, мет.
Характер радикала аминокислот определяет характер аминокислоты:
1. Неполярные (гидрофобные) АК : вал, лей, иле, фен, ала;
2. Полярные:
а) незаряженные сер, тре, тир, глн, асн, цис;
б) заряженные положительно арг, лиз, гис;
в) заряженные отрицательно асп и глу;
При соединении АК между собой пептидными связями образуются пептидные цепи различной длины. Если пептид содержит более 50 аминокислот, то его считают белком.
Схема образования пептида:
R COOH + NH2 CH СOОH = R CO NHCH СOОH + HOH
| | | |
NH2 R2 NH2 R2
Специфические особенности различных белков и пептидов определяется количеством аминокислот и тем, какие аминокислоты и в каком порядке формируют молекулу белка. Количество аминокислотных остатков в белках может быть от двух сотен до нескольких тысяч. Даже при одинаковом количестве аминокислот и одинаковых аминокислотах могут существовать различные белки и пептиды, если у них разная последовательность аминокислот. Например, гормон вазопрессин и окситоцин состоят из девяти АК. Последовательность аминокислот:
в вазопрессине: цис-тир- фен- глн- асн- цис- про- арг- глу,
в окситоцине: цис-тир- иле- глн- асн- цис-про- лей- глу
Вазопрессин и окситоцин человека отличаются всего двумя АК (третьей и восьмой), но это ведет к существенному отличию в химическом строении и биологическом действии.
В организме человека имеются специализированные белки, в которых доля некоторых АК очень высока. Например, в коллагене 30% остатков глицина и 20% остатков пролина. Белки гистоны содержат 35% аргинина и лизина, поэтому обладают основным характером, в воде заряжаются положительно.
3. Принципы структурной организации белков
Любой индивидуальный белок характеризуется не только аминокислотным составом, но и природной (нативной) структурой. От пространственной структуры белка зависят физико-химические, питательные и функциональные свойства белков, определяющие их усвояемость, переваривание, качество пищевых продуктов, поведение в технологических процессах и при хранении пищевого сырья.
Различают четыре уровня структуры белковой молекулы: первичную структуру, вторичную, третичную и четвертичную (Рис.1). Каждый уровень структуры обусловлен определенным типом химической связи.
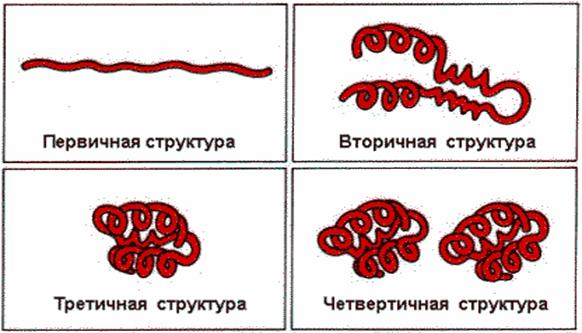
Рис. 1. Уровни организации белковой молекулы
Под первичной структурой понимают последовательность соединения аминокислот в пептидную цепь, эта структура обусловлена пептидной связью. Под вторичной структурой понимают конфигурацию в пространстве остова пептидной цепи, состоит из группировок NH CH CO и обусловлена водородными связями (Рис.2). Спираль можно представить в виде ленты, расположенной на поверхности воображаемого цилиндра.
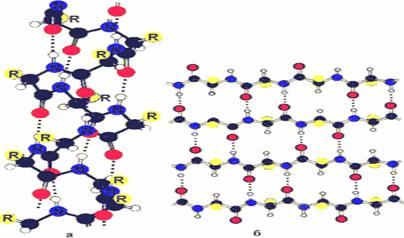
Рис. 2. Вторичная структура белков (а - α-спираль; б складчатый лист)
Пептидная цепь, содержащая домены, имеющие индивидуальную вторичную структуру в пространстве приобретает относительно компактную структуру (глобулу или вытянутое волокно), за счет взаимодействия атомов радикалов аминокислот. Для многих белков эта третичная структура является полной пространственной структурой, то есть природной. Третичная структура обусловлена различными видами взаимодействий боковых радикалов аминокислот (рис. 3). При формировании третичной структуры гидрофобные радикалы локализуются внутри глобулы, а гидрофильные на ее поверхности.
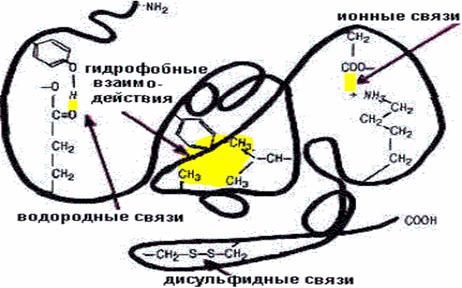
Рис. 3. Схема связей, стабилизирующих природную структуру белков», третичная структура белков
Формирование трехмерной структуры белков важнейший биологический процесс, так как именно от пространственной структуры зависят биологические свойства белков. Процесс формирования пространственной структуры синтезирующегося белка обозначается термином «фолдинг белков».
Многие белки характеризуются четвертичной структурой. Она реализуется за счет комбинации субъединиц их самостоятельных пептидных цепей. Субъединицы соединяются между собой слабыми нековалентными взаимодействиями. Четвертичная структура характерна для многих ферментов (ЛДГ, глутаматДГ).
4. Незаменимые аминокислоты. Роль аминокислот в обмене веществ.
С чем связана необходимость поступления белков в организм с пищей? Ежесуточно 40 г белка из 6 кг, составляющих белковый "фонд" организма, подвергается распаду до конечных продуктов и должно быть возмещено эквивалентным количеством вновь образованных белков за счет биосинтеза из аминокислот. Так как резерва аминокислот в организме нет, то они должны поступать в составе белков пищи. 10 аминокислот из двадцати, входящих в состав белков могут синтезироваться в организме из углеводородных фрагментов в реакции аминирования. Это заменимые аминокислоты аланин, глицин, аспарагиновая кислота, глутаминовая кислота, аспарагин, глутамин, тирозин, серин, цистеин, пролин. Восемь аминокислот незаменимые, их углеводородные фрагменты не синтезируются в животном организме, поэтому эти кислоты должны поступать в составе белков корма. Это валин, лейцин, изолейцин, метионин, треонин, лизин, фенилаланин, триптофан (аргинин, гистидин частично незаменимые для взрослых животных и незаменимые для молодняка). Условно незаменимыми являются тирозин и цистеин, так как для их синтеза необходимы незаменимые аминокислоты фенилаланин и метионин.
В зависимости от аминокислотного состава различают полноценные и неполноценные белки. Неполноценным белком считается такой, который не содержит хотя бы одной незаменимой аминокислоты. Полноценными белками являются белки животного происхождения, неполноценные являются растительные белки. Если белок содержит все незаменимые аминокислоты в необходимых пропорциях и легко подвергается действию протеолитических ферментов, то он считается полноценным и его биологическая ценность такого белка условно принимается за 100 единиц (белки яиц, молока). Белки говядины имеют биологическую ценность 98, белки кукурузы 36. растительные белки бедны метионином, триптофаном, лизином.
Несбалансированность аминокислот в рационе пагубно влияет на детей, люди старших возрастных групп имеют сложившиеся ферментные системы, позволяющие выводить из организма токсичную аминокислоту. Последствия нарушения белкового обмена у детей практически невозможно устранить какими-либо способами.
Недостаток диаминомонокарбоновых кислот аргинина и лизина приводит к снижению скорости синтеза основных белков, формирующих хроматин хромосом протаминов и гистонов. Замедляется рост, наблюдается нарушение функции двигательного аппарата, вплоть до паралича.
Недостаток серусодержащих аминокислот метионина, цистеина замедляет синтез белков соединительной ткани коллагена и кератина.
При недостаточном содержании триптофана кроме снижения скорости синтеза различных белков, возникает авитаминоз никотиновая кислота, так как она может синтезироваться из этой аминокислоты.
Лейцин. Относительный избыток его по сравнению с другими незаменимыми аминокислотами угнетает рост из-за соответствующего нарушения усвоения изолейцина.
Гистидин. Недостаток его сопровождается снижением концентрации гемоглобина.
Метионин. Исключение его из пищи сопровождается жировым перерождением печени, обусловленным недостатком лабильных метальных групп для синтеза лецитина.
Валин. Недостаток его ведет к задержке роста, потере массы.
Заменимые аминокислоты существенно влияют на потребность в незаменимых аминокислотах. Например, потребность в метионине определяется содержанием цистина в диете. Чем больше в пище цистина, тем меньше расходуется метионина для биологического синтеза цистина.Если в организме скорость синтеза заменимой аминокислоты становится недостаточной, появляется повышенная потребность в ней. Некоторые заменимые аминокислоты становятся незаменимыми, если они не поступают с пищей, так как организм не справляется с быстрым их синтезом. Так, недостаток цистина ведет к торможению роста клеток даже при наличии всех остальных аминокислот в среде. Нарушения синтеза белка возникают при патологической мутации структурных генов. Если в опероне синтеза даже один из структурных генов будет патологическим, то синтезированная и-РНК несет ошибочную информацию о виде и месте включения.
5. Углеводы, липиды, пептиды
Углеводы обширный класс органических соединений, которые по химической природе являются альдегидоспиртами (содержат одну карбонильную и несколько гидроксильных групп). К ним относятся моносахариды и образованные ими олиго- и полисахариды.
В биосфере углеводов больше, чем веществ других классов вместе взятых. Основная масса органического вещества в биосфере приходится на полисахарид целлюлозу (клетчатку) 80% от общей массы. Углеводы (глюкоза) синтезируются в зеленых растениях из углекислого газа и воды в процессе фотосинтеза за счет энергии солнечного света. Углеводы являются одним из основных компонентов пищи человека и животных (57-70% суточного рациона). Животные получают углеводы, преимущественно полисахариды, с растительными кормами. Основной углевод пищи человека крахмал.
Основной углевод клеток животных моносахарид глюкоза, ее главная биологическая функция энергетическая. При окислении 1 г глюкозы в животном организме до конечных продуктов 4,1 ккал (16,7 кДж), при этом покрывается 50-60% энергозатрат организма. Причем такие органы, как головной мозг, используют в качестве источника энергии только глюкозу. Углеводы классифицируют на: моно-, ди- и полисахариды.
Клетчатка (целлюлоза) самый распространенный в природе биополимер, линейная молекула построена из остатков β-глюкозы. Основной компонент стенок растительных клеток. Ежегодно продуцируется растениями 1011 т целлюлозы. Содержание клетчатки в семенах хлопчатника 98%, древесине 40-50%, зернах злаковых 3-4%, кожуре семян подсолнечника 15%. Мономером молекулы клетчатки является β-глюкоза. Продукты гидролиза клетчатки используются в производстве спирта, кормовых дрожжей.
К сложным углеводам, относятся пектины группа высокомолекулярных полисахаридов, входящих в состав клеточных стенок растений и содержащихся в клеточном соке. Больше всего пектина в топинамбуре, яблоках, сливах, абрикосах, в моркови, свекле и др. Основным структурным компонентом пектинов является галактуроновая кислота. Цепи полимера образуют сетчатую структуру, благодаря соединению ионов металлов с неэтерифицированными группами -ОН.Пектины способны связывать и выводить из организма такие токсичные поливалентные металлы, как свинец, кобальт, ртуть, кадмий, хром, цинк, железо, стронций и др. При этом образуются нерастворимые безвредные для организма комплексные соединения. Так, 1 г пектина связывает от 160 до 420 мг стронция. Наибольшим защитным эффектом в связывании радиоактивных металлов обладают пектины яблок. На способности пектиновых веществ образовывать гели в присутствии сахаров в кислой среде основано использование их в кондитерской и консервной промышленности.
В растениях пектины находятся в виде нерастворимого протопектина, который может переходить в растворимую форму либо при кислотном гидролизе, либо под действием протопектиназы (при технологической обраблтке плодов и овощей). При созревании и хранении плодов происходит переход нерастворимого пектина в растворимый, с этим связано размягчение плодов. Важное свойство пектина способность к желированию (образуют прочные студни в 65-70% растворах сахаров при рН 3,1-3,5. Массовая доля пектина при этом составляет 0,2-1,5%. Гели пектинов обладают высокой водопоглощающей способностью (1 г пектина поглощает 60-150 г воды). на желирующей способности пектинов основано их применение в производстве конфитюров, мармелада, пастилы, желе, джемов.
Гемицеллюлозы сложные полисахариды, вместе с пектинами и лигнином образуют матрикс клеточных стенок растений. Различают ксиланы, мананы и галактаны в зависимости от структурного компонента гемицеллюлоз.
К полисахаридам близки камеди (образуются при повреждении тканей растений) и слизи (находятся в покровных тканях семян льна, зерновки ржи), мономерами их являются арабиноза, галактоза, ксилоза, рамноза, а также глюкуроновая и галактуроновая кислоты. камеди при набухании в воде образуют вязкие гели, слизи слизистые массы. Гуаровую камедь получают из семян гуара, или горохового дерева (Cyamopsis tetraganoloba). С 1907 года гуаровое дерево признано источником сырья растительного происхождения, пригодного как корм для крупного рогатого скота. С 1957 г. гуаровая камедь была внедрена на международный рынок как загуститель. На 100 литров воды необходимо всего на всего 50-70 г гуаровой камеди для образования загустевшей субстанции, которая может быть использована в производстве майонезов, кетчупов, мороженого, растительных сливок и т.п.
Липиды это гетерогенная группа органических соединений тканей животных и растений непосредственно или опосредованно связанных с высшими жирными кислотами. Их общими свойствами являются относительная нерастворимость в воде и растворимость в полярных растворителях.
Основу химической структуры липидов составляют углеводородные звенья. Молекулы простых липидов это сложные эфиры высших карбоновых кислот и спиртов. Основными компонентами липидов являются спирты: глицерол, холестерол, а также сфингозин, миристиловый и другие; жирные кислоты (ЖК): пальмитиновая, стеариновая, олеиновая. Кроме этих основных компонентов в состав липидов могут входить: фосфорная кислота, этаноламин, инозит, холин, серин.
В природных жирах обнаружены жирные кислоты только с четным числом атомов углерода, наиболее распространены кислоты с 16-18 атомами углерода. Предельные жирные кислоты и непредельные с одной двойной связью поступают в организм с липидами корма или синтезируются в организме. Полиненасыщенные жирные кислоты (ПНЖК) с двумя и более двойными связями не синтезируются в организме животных и должны поступать с кормом, то есть они являются незаменимыми пищевыми факторами. Ненасыщенные жирные кислоты являются только цис-изомерами.
Для функционирования биологических систем особенно важны две группы полиненасыщенных жирных кислот: омега-6 (линоленовая кислота, источником которой являются льняное и конопляное масла) и омега-3 Линоленовая и арахидоновая кислоты. Кислоты омега-6 омега-3 отличаются положением первой двойной связи от радикала СН3. Омега-6-ПНЖК содержатся в большинстве пищевых растительных масел (подсолнечном, кукурузном, кунжутном, виноградном), а также в мясе и жире животных. Особенно много их свином жире. Основной продуцент омега-3-ПНЖКморские водоросли. Эти кислоты входят в состав так называемых "жиров морского типа". Их содержание особенно велико в рыбьем жире, мясе лосося, макрели, сардин, тюленей, моржей, китов.
ПНЖК в составе мембранных
липидов повышают текучесть клеточных мембран, что позволяет гормонам и
другим веществам легко проникать внутрь клеток, при этом улучшается
метаболизм в клетках. Арахидоновая кислота является субстратом в
синтезе простагландинов, которые стимулируют рост клеток, оказывают
противовоспалительное действие и регулируют коагулирующие свойства
крови. Соответственно, потребление больших количеств жиров и масел,
содержащих омега-6-ПНЖК, ведет к несколько большей устойчивости к
инфекционным заболеваниям, но при этом повышает риск развития
ишемической болезни сердца. Следует учитывать, что кислоты омега-6
очень окисляемы. Их окисляемость особенно велика при недостаточном
поступлении в организм антиоксидантов витаминов А, С и Е,
бета-каротина, цинка. Дефицит ПНЖК в питании приводит к жировому
перерождению печени, болезням мочеполовой и репродуктивной систем.
Наиболее оптимальное сочетание ПНЖК между омега-3 и омега-6 1 : 4.
Дневная норма ПНЖК омега-3 равна примерно 1-2 г; столько этих веществ
содержится, например, в 100 г сельди или одной-двух чайных ложках
рапсового масла.
У эскимосов, которые потребляют с рыбой и китовой печенью в среднем 14 г
омега-3 в день практически не бывает сердечно-сосудистых заболеваний.
В продуктах питания могут присутствовать транс-изомеры жирных кислот (ТИЖК). Они образуютсят при частичной гидрогенации жидких масел (в производстве маргаринов). Трансжиры содержащатся практически во всех видах промышленно-произведенной выпечки, салатных заправках, пончиках, картофельных чипсах, панированной на заводе курице и рыбе и так далее. Для сохранения здоровья необходимо избегать всего, что приготовлено на маргарине и содержит "частично гидрогенизированные" жиры и масла.
По биологическим функциям липиды подразделяют на три основные группы:
1. структурные или рецепторные компоненты мембран. Неполярные липиды служат электроизоляторами, обеспечивая быстрое распространение волн деполяризации вдоль миелиновых волокон (фосфолипиды, холестериды, сфинголипиды);
2. эффективный источник энергии - либо непосредственно используются, либо потенциально в форме «депо» энергии в организме (триацилглицеролы ТАГ);
3. передатчики биологических сигналов (жирорастворимые витамины и стероидные гормоны).
По состоянию липидов в организме их можно разделить на две группы:
резервные жиры, выполняющие роль метаболического топлива это ТАГ жировой ткани (подкожной клетчатки, сальника, брыжейки).
протоплазматические липиды содержатся в комплексе с углеводами и белками в мембранах клеток (фосфо- и гликолипиды).
Природные пептиды содержат не более 50 аминокислотных остатков. В живых организмах обнаружено несколько сотен различных пептидов, выполняющих важнейшие функции. Это гормоны, токсины, антибиотики и другие биологически активные вещества.
Глутатион трипептид глу-цис-гли. Обнаружен в клетках животных, особенно много его в хрустлике глаза, в мозге. Он принимает активное участие в окислительно-восстановительных процессах:
2G-SH - 2H = G-S-S-G
Основная функция глутатиона заключается в защите сульфгидрильных групп белков от окисления. Он выполняет также роль кофермента некоторых ферментов.
Пептиды каллидин и брадикинин плазмы крови повышают проницаемость капилляров, обладают мощным сосудорасширяющим действием, являются сильнейшими возбудителями болевых ощущений.
Опиоидные пептиды группа нейропептидов, оказывающих моделирующее влияние на передачу нервных импульсов в ряде отделов ЦНС. Они принимают участие в регуляции процессов, связанных с восприятием боли, влиянием гормонов на обмен веществ, воздействуют на сердечно-сосудистую деятельность, стрессорные реакции и ряд других физиологических функций.
Некоторые гормоны также являются пептидами: например, АКТГ, вазопрессин, окситоцин, когерин, МСГ
Прионы являются принципиально новым классом патогенов, вызывающих неизлечимые болезни центральной нервной системы у человека и животных.
Прионы отличаются от всех прочих инфекционных патогенов (вирусы, бактерии) тем, что у них отсутствует какой-либо геном, состоящий из ДНК или РНК. Наиболее известные прионные болезни человека - это болезнь Крейцфельда-Якоба (БКЯ) и синдром Герстмана-Штраусслера-Шейнкера (ГШШ), а у животных - скрэйпи овец и губчатая энцефалопатия крупного рогатого скота ("коровье бешенство"). Эти заболевания сопровождаются морфологическими изменениями тканей мозга и появлением в них амилоидоподобных бляшек, содержащих нитевидные белковые агрегаты.
Вопросы для самопроверки
4. Дайте определение понятий: "первичная", "вторичная", "третичная структура" белковой молекулы.
5. Перечислите химические связи, обуславливающие природную структуру белковой молекулы.
6. Назовите виды взаимодействия в белковой молекуле между радикалами аминокислот: ала и вал; фен и лей; тир и сер: асп и глу. Приведите схемы образования связей.
7. Какие аминокислоты называют незаменимыми? Перечислите эти аминокислоты.
8. Какими аминокислотами бедны белки растительного происхождения?
7.